reacción química o cambio químico es todo proceso químico en el cual una o más sustancias (llamadas reactantes), por efecto de un factor energético, se transforman en otras sustancias llamadas productos. Esas sustancias pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro.
Las reacciones químicas se expresan de la siguiente manera:
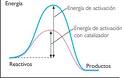
Con una ecuación química que es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (reactivos ó reactantes) y las sustancias o productos que se obtienen. También nos indican las cantidades relativas de las sustancias que intervienen en la reacción. Las ecuaciones químicas son el modo de representarlas.
Continuamente se producen reacciones químicas en la atmósfera, en las fábricas, en los vehículos o en nuestro organismo. En una reacción química, uno o más tipos de materia se transforman en uno o varios tipos distintos de materia. Aquí se muestran algunas reacciones químicas comunes. Sin estos procesos no existiría la vida tal como la conocemos: las plantas no podrían llevar a cabo la fotosíntesis, los automóviles no se moverían, los flanes no cuajarían, los músculos no podrían quemar energía, los adhesivos no pegarían y el fuego no ardería.
Como podemos ver las reacciones químicas cotidianas tienen gran importancia en el entorno en que nos encontramos ya que sin ellas no podrían existir un sin numero de cosas.
Sin las reacciones químicas no podríamos hacer tareas tan sencillas como lo son: el proceso de digestión o simplemente el poder respirar lo cual lo vemos como una tarea sencilla pero tiene una gran importancia y esto es resultado un proceso químico.
Otro ejemplo que podemos ver cotidianamente es cuando la madera que arde en la hoguera está sufriendo un cambio sustancial. Asimismo, el hierro de una verja cambia su naturaleza al oxidarse convirtiéndose en óxido férrico: el gris refulgente del metal puro se transforma en pardo rojizo tras su combinación con el oxígeno del aire.
Otro ejemplo de una reacción química es el proceso de combustión a la hora de encender un cerillo.
También así mismo la fotosíntesis es un resultado de proceso químico.
La importancia que tienen los procesos químicos que conllevan una reacción química es que sin ellos no podría existir la vida humana ya que en varios procesos se crea el dióxido de carbono el cual lo inhalamos y al exhalarlo se convierte en CO2 y esto también demuestra que el humano dentro de sus funciones tiene procesos químicos.
También estas mismas reacciones químicas tienen un gran importancia socioeconómica ya que con estas hemos logrado un gran avance tecnológico y socioeconómico pues se ha logrado a base de buenas investigaciones y procesos químicos.
Gracias al gran manejo de investigación y desarrollo sobre las reacciones químicas se han podido hacer varios avances científicos, los cuales se basan en las satisfacciones y comodidades del hombre; también gracias a estas investigaciones podemos entender mejor los procesos químicos, causas y consecuencias de estos mismos.